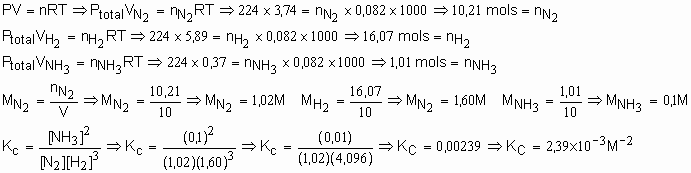01. Três mols de gás amoníaco (NH3) são colocados num recipiente. Com aquecimento conveniente, estabelece o seguinte equilíbrio gasoso: 2NH3 « N2 + 3H2. Calcular o grau de dissociação (em %) do NH3, sabendo que no equilíbrio existem 2,7 mols desse gás.

02. Um mol de gás hidrogênio, 0,5 mol de gás oxigênio e 2 mols de H2O(g) encontram-se em equilíbrio num recipiente de 0,5L de capacidade, a certa temperatura. Determine o valor da constante de equilíbrio para o equilíbrio: H2O « H2 + O2 R: 0,25M
03. Calcule a constante de equilíbrio, em termos de concentração, para a reação representada pela equação química SO2 + O2 « SO3, sabendo que nas condições de temperatura e pressão em que se encontra o sistema existem as seguintes concentrações dos compostos presentes no equilíbrio: [SO3]= 0,1M; [O2]= 1,5M e [SO2]= 1,0M. R: 0,0066 M-1
04. Cinco mols de gás amoníaco (NH3) são colocados num recipiente. Com aquecimento conveniente, estabelece o seguinte equilíbrio gasoso: NH3 « N2 + H2. Calcular o grau de dissociação (em %) do NH3, sabendo que no equilíbrio existem 4,0 mols desse gás. R: 20%
05. Em um sistema em equilíbrio, a 25O C, as concentrações de NOCl(g), NO(g) e Cl2(g) são, respectivamente, 5M, 5x10-5M e 2M. Calcule o Kc a 25O C para a reação NOCl « NO + Cl2. R= 2x10-10M
06. Num recipiente de 2 L de capacidade encontra-se o seguinte sistema gasoso em equilíbrio: N2 + H2 « NH3 . Calcular o valor da constante de equilíbrio, sabendo que no equilíbrio existem 2 mols de N2, 4 mols de H2 e 1 mol de NH3. R=0,03125 M-2
07. O pentacloreto de fósforo é um reagente muito importante em Química orgânica . Ele é preparado em fase gasosa através da reação: PCl3 + Cl2 « PCl5. Um frasco de 3 L contém as seguintes quantidades de equilíbrio, a 200O C: 0,12 mol de PCl5; 0,600 mol de PCl3 e 0,0120 mol de Cl2. Calcule o valor da constante de equilíbrio químico, a essa temperatura. R= 50 M-1
08. São misturados 2 mols de gás hidrogênio (H2) com 3 mols de gás cloro (Cl2) num recipiente fechado de V litros de capacidade, a certa temperatura. Calcular o valor da constante de equilíbrio para a formação do gás HCl, sabendo que 80% do gás hidrogênio reagiu. R@ 18,3
09. Efetuando, num recipiente fechado, a certa temperatura, a reação entre dióxido de enxofre gasoso (SO2) e gás oxigênio (O2), verificou-se que, após estabelecido o equilíbrio, existiam 2 mols de SO2, 1,5 mols de O2 e 4 mols de SO3(g). Sabendo que a capacidade do recipiente é de 0,5L, determinar o valor da constante de equilíbrio para a reação SO2 + O2 « SO3. R:1,33M-1
10. Num recipiente de 2 L de capacidade são colocados 3,6g de H2O(g). Com aquecimento, estabelece-se o equilíbrio gasoso: H2O « H2 + O2. Sabendo que o grau de dissociação da água é de 5%, calcular a constante de equilíbrio químico.
|
2H2O « 2H2 + 1O2 |
|
|
Inicial |
0,2 mol - - |
|
Dissociação |
0,2x5% - - |
|
Reag/Form. |
0,01mol 0,01mol 0,005 |
|
Equilíbrio |
0,19mol 0,01mol 0,005 |
|
[ ]= |
|
11. Num recipiente de um litro de capacidade misturam-se 2 mols de CO(g) e 2 mols de O2(g) . A certa temperatura estabelece-se o equilíbrio gasoso: CO + O2 « CO2 . Calcule o valor da constante Kc para esse equilíbrio, sabendo que 90% de CO reagiram. R: 73,6 M-1
12. Dois mols de gás hidrogênio são misturados com um mol de gás oxigênio num recipiente de 500 mL de capacidade. Determinar o valor da constante de equilíbrio para a formação de H2O(g), sabendo que 80% do gás hidrogênio reagiram. R: 40 M
13. Um mol de H2O(g) é colocado num recipiente de 2 L de capacidade. A determinada temperatura 60% do H2O(g) sofrem decomposição. Determine o valor do Kc para o equilíbrio estabelecido. R: 0,34 M
14. Num recipiente fechado encontram-se, a determinada temperatura, 1,8 mols de HCl(g) em equilíbrio com H2(g) e Cl2(g). Determine o grau de dissociação do HCl(g) nessa temperatura, sabendo que inicialmente foram colocados 2 mols de HCl(g) no recipiente. R: 10%
15. Foram colocados x mols de HCl(g) num recipiente e, a seguir, aquecidos a uma temperatura t. Atingida a temperatura t, estabelece-se o equilíbrio: HCl(g) « H2(g) + Cl2(g). Sabendo que no equilíbrio existem 1,2 mols de HCl e que o seu grau de dissociação é de 30%, calcule o valor de x. R=1,71 mol
16. São colocados 22g de CO2(g) num recipiente de 1,5L de capacidade. A certa temperatura estabelece-se o equilíbrio: CO2(g) « CO(g) + O2(g) . Determine a constante Kc desse equilíbrio, sabendo que o grau de dissociação do dióxido de carbono é de 10% nessa temperatura. R=2,04x10-4 M
17. No equilíbrio gasoso HI « H2 + I2 , encontramos as seguintes concentrações molares 10M de H2 e 0,01M de I2. Qual a concentração molar do HI, sabendo que, nas condições de experiência, Kc vale 10-3. R=10
18. Um mol de gás hidrogênio e um mol de I2(g) são misturados a 500O C. As substâncias reagem e, após certo tempo, chega-se a um equilíbrio, onde se constata a presença de 0,22 mol de hidrogênio residual. Qual a constante de equilíbrio Kc, nessas condições para a reação H2 + I2 « HI? R=50,28
19. Considere o seguinte sistema em equilíbrio: H2(g) + Cl2(g) « HCl(g) , Verifica-se que, para esse equilíbrio, a certa temperatura, as pressões parciais dos componentes são: pH2 = 0,5 atm; pCl2 = 0,4 atm e pHCl = 0,6 atm. Determinar o valor da constante de equilíbrio em termos de pressões parciais (Kp).
20. Calcule o valor do Kp do sistema gasoso em equilíbrio: N2 + H2 « NH3 sabendo que, nesse equilíbrio, a determinada temperatura, as pressões parciais dos componentes são pN2 = 0,5 atm; pH2 =1,5 atm e pNH3 = 2 atm. R= 2,37 atm-2
21. A certa temperatura as pressões parciais dos componentes, no equilíbrio gasoso: H2 + O2 « H2O são pH2 =0,6 atm; pO2 =0,2 atm e pH2O = 0,8 atm. Determine o valor do Kp. R= 8,9 atm-1
22. Num recipiente de 2 L de capacidade encontram-se 1,8g de H2O(g), 2,0g de H2(g) e 1,6g de O2(g) em equilíbrio, a 427OC. Calcule o valor da constante de equilíbrio em termos de pressões parciais (Kp) para o equilíbrio gasoso: H2O « H2 + O2 .

23. O equilíbrio gasoso H2 + Cl2 « HCl se estabelece, a 27O C, com 4,0g de H2 , 35,5g de Cl2 e 73,0g de HCl num recipiente de 1 L de capacidade. Calcule o valor da constante Kp. R= 4
24. A 27O C, a constante Kc do equilíbrio gasoso H2 + Cl2 « HCl vale 20. Calcule o valor da constante Kp. R= 20
25. Num recipiente fechado são introduzidos 20 mols de HI(g). Aquecendo esse recipiente a 450O C, verifica-se que o equilíbrio se estabelece com a decomposição de 25% do HI. Calcule o valor de Kc e Kp para o equilíbrio gasoso HI « H2 + I2. R= 0,028 e 0,028
26. Calcule o valor da constante de equilíbrio em termos de pressões parciais, a 127O C, para o equilíbrio gasoso SO2 + O2 « SO3 , sabendo que a constante de equilíbrio químico vale 40 M-1. R= 1,22 atm-1
27. Um recipiente fechado contém, a 450O C, 13g de gás hidrogênio, 508g de I2(g) e 1920g de HI(g) em equilíbrio, segundo a equação H2 + I2 « HI. Calcule o valor de Kc e Kp. R= 17,3 e 17,3
28. A constante Kp do equilíbrio gasoso NO + O2 « NO2 é igual a 0,04 atm-1, a 147O C. Descubra o valor da constante Kc. R= 1,38 M-1
29. São aquecidos, a 527O C, 5,1g de NH3(g) num recipiente de 800 mL de capacidade. Calcule o valor de Kc e Kp para o equilíbrio gasoso NH3 « N2 + H2 , sabendo que 5% do NH3 se dissociam. R= 1,63x10-6M2; 7,0x10-3 atm2
30. No equilíbrio gasoso CO + O2 « CO2 , o Kc vale 2,24x1022, a 727O C. Qual o valor de Kp na mesma temperatura? R= 2,73x1020 atm-1
31. Num recipiente fechado mantido a temperatura constante foram introduzidos monóxido de carbono e vapor de água em quantidades tais que suas pressões parciais eram iguais e valiam 0,856 atm cada uma. Após certo tempo, estabeleceu-se o equilíbrio gasoso CO + H2O « CO2 + H2. Medindo-se então a pressão parcial de CO, obteve-se 0,580 atm. Qual o valor da constante de equilíbrio Kp?
|
CO + H2O « CO2 + H2 |
|
|
Inicial |
0,856 atm 0,856 atm - - |
|
Reag/Form. |
0,276 atm 0,276 atm 0,276 atm 0,276atm |
|
Equilíbrio |
0,580 atm 0,276 atm 0,276 atm 0,276atm |
32. Calcule o valor do Kc, a 47O C, do equilíbrio gasoso ClO2 « Cl2 + O2 , sabendo que nessa temperatura a constante Kp é igual a 0,8 atm. R= 0,03M
33. A pressão de um sistema gasoso constituído por CO2, O2 e CO, em equilíbrio, é de 2 atm, a dada temperatura. Tendo em conta que no sistema em questão existem 30% de CO2 e 20% de O2, em volume, calcule:
a) a pressão parcial de CO;
b) a constante de equilíbrio do sistema CO2 « O2 + CO em termos de pressão;
c) a constante de equilíbrio em termos de pressão para a reação inversa.
|
% de CO = 100 – (% de CO2 + % de O2) è % de CO = 100 – (20+30) è % de CO = 50% PCO = % de CO x PTotal è PCO = 0,5 x 2 atm è PCO = 1,0 atm (1ª resposta) PCO2 = % de CO2 x PTotal è PCO2 = 0,3 x 2 atm è PCO2 = 0,6 atm PO2 = % de O2 x PTotal è PO2 = 0,2 x 2 atm è PO2 = 0,4 atm |
|
|
b) |
c) |
34. Calcule a constante de equilíbrio em termos de pressão parcial para a reação CO + H2O « CO2 + H2 em fase gasosa, sabendo que num recipiente de 20 L de capacidade, mantido a 1727O C, estão em equilíbrio 0,855 mol de CO, 0,855 mol de H2O, 1,145 mol de CO2 e 0,145 mol de H2. R=0,227 (Kp=Kc)
35. Num recipiente fechado, indeformável e a uma dada temperatura, aquece-se 0,4 mol de NH3. Estabelecido o equilíbrio NH3 « N2 + H2 verifica-se que há 0,30 mol de hidrogênio no sistema. Calcule o grau de dissociação térmica do NH3, àquela temperatura. R= 50%
36. Em um recipiente de 500 mL, encontram-se, em condições de equilíbrio, 0,48g de NO2 e 2g de N2O4. Calcule a constante de equilíbrio, em termos de concentração, para a reação NO2 « N2O4. R=100,31M-1
37. À temperatura de 25O C temos:
H+ + OH- è H2O velocidade da reação: v1= 1011 [H+][OH-] e
H2O è H+ + OH- velocidade da reação: v2= 2x10-5 [H2O]
Qual deve ser, a 25O C, o valor da constante de equilíbrio da reação representada por H+ + OH- « H2O?
38. Calcular o Kc da reação gasosa H2 + S2 « H2S, a 750OC, sabendo que num recipiente de 90L de capacidade estão em equilíbrio, 13,7g de H2, 9,2x10-3g de enxofre e 285,6g de sulfidreto. Calcular também o Kc da reação inversa na mesma temperatura. R=9,4x105 M-1 e 1,06x10-6M
39. Num recipiente de 10L, estão em equilíbrio, a 727O C e sob pressão total de 224 atm, 3,74L de N2, 5,89L de H2 e 0,37L de NH3. Calcular o Kc do equilíbrio N2 + H2 « NH3, nas condições da experiência.