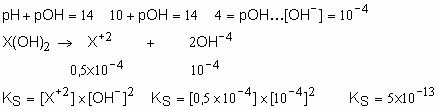Produto de solubilidade:
Experimentalmente, descobriu-se que, em uma solução saturada, a certa temperatura, de um eletrólito pouco solúvel, é constante o produto das concentrações molares dos íons, elevadas a potencias correspondentes aos coeficientes desses íons na equação química de dissociação. Essa constante recebe o nome de constante de solubilidade (Ks) ou produto de solubilidade (PS).
1-Escreva a expressão da constante de solubilidade dos seguintes compostos
a)BaCO3
b)CaSO4
c)Al(OH)3
d)Ag2CrO4
e)CoS
f)Mg(OH)2
g)Fe(OH)3
h)Zn(OH)2
i)PbCl2
j)Ag2S
l)Pb3(PO4)2
m)CaF2
n)PbBr4
o)Fe4(P2O7)3
p)FeS
2-Sabendo que a solubilidade do cromato de prata – Ag2CrO4 – é de 2,5x10-2 g/L, a determinada temperatura, calcular o seu produto de solubilidade nessa temperatura. R=1,7x10-12M

3-Calcule o Ks do fosfato de prata – Ag3PO4,
sabendo que a sua solubilidade é de 6,5x10-3 g/L.
R=1,59x10-18
4-A solubilidade do fosfato de chumbo II – Pb3(PO4)2
– é de 1,4x10-4 g/L. Determine o Ks desse sal.
R:1,62x10-32
5-Determine o produto de solubilidade do cloreto de chumbo II
– PbCl2 – cuja solubilidade é de 11g/L.
R=2,37x10-4
6-A solubilidade do hidróxido férrico – Fe(OH)3
– em uma determinada temperatura é de 4,82x10-8 g/L. Determine o
seu produto de solubilidade nessa temperatura.
R=1,1x10-36
7-A solubilidade do carbonato de bário – BaCO3
– é de 1,3x10-2M. Descubra o produto de solubilidade desse sal.
R=1,69x10-4
8-Prepara-se um litro de uma solução saturada de cloreto de
prata – AgCl . Calcule a constante de solubilidade, sabendo que foi dissolvido
1,7x10-3g desse sal.
R=1,4x10-10
9-Determinar a solubilidade (em mol/L) do sulfeto de prata (Ag2S) a certa temperatura, sabendo que o produto de solubilidade nessa temperatura é 1,6x10-48.

10-Sabe-se que o Ks do fosfato de prata – Ag3PO4
, a 25O C, é 1,56x10-48. Determine a solubilidade do sal
nessa temperatura.
R=4,8x10-13
11-Calcule a solubilidade em água, a 18O C, do
sulfeto férrico – Fe2S3 – sabendo que nessa
temperatura o seu produto de solubilidade é 3,456x10-52.
R=2x10-11
12-O produto de solubilidade, a 20O C, do
hidróxido férrico – Fe(OH)3 – é 1,16x10-16.
Descubra a solubilidade, a 20O C, em g/L , dessa base.
R=4,8x10-3 g/L
13-Calcule a solubilidade do sulfeto de manganês II – MnS
– em g/L, sabendo que o seu produto de solubilidade é 2x10-15 .
R=3,88x10-6
14-Descubra a massa de sulfeto de ferro II – FeS –
necessária para que sejam preparados 500 mL de solução saturada desse sal,
sabendo que o seu produto de solubilidade é 4x10-19.
R=2,78x10-8
15-Quantos gramas de sulfato de bário – BaSO4
– são necessários para preparar um litro de solução saturada, sabendo que
o produto de solubilidade desse sal é 1,1x10-10?
R=2,44x10-3
16-A dose letal de íons Ba+2 para o ser humano é
de 2x10-3 mol de íons Ba+2 por litro de sangue. Para se
submeter a um exame de raios-X, um paciente ingeriu 200 mL de uma suspensão de
sulfato de bário – BaSO4 . Supondo-se que os íons Ba+2
solubilizados na suspensão foram integralmente absorvidos pelo organismo e
dissolvidos em 5 litros de sangue, discuta se essa dose coloca em risco a vida
do paciente, considerando que o produto de solubilidade do sulfato de bário é
igual a 1x10-10 M.
R=Não coloca em risco, pois [Ba+2]=4x10-7M
17-Em um béquer foram misturadas soluções aquosas de cloreto de potássio, sulfato de sódio e nitrato de prata, ocorrendo, então, a formação de um precipitado branco, que se depositou no fundo de um béquer. A análise da solução sobrenadante revelou as seguintes concentrações: [Ag+]=1,0x10-3M; [SO4-2]=1,0X10-1M e [Cl-]=1,6X10-7M. De que é constituído o sólido formado? Justifique com cálculos.
|
Composto |
Produto de solubilidade |
Cor |
|
|
Dados |
Cloreto de prata – AgCl |
1,6X10-10 |
Branca |
|
Sulfato de prata – Ag2SO4 |
1,4X10-5 |
Branca |
Note que para o sulfato de prata , o Ks não é alcançado (1,4x10-5), indicando que a presença de íons Ag+ e Cl- é a máxima possível na solução. Então, se houver formação de precipitado, este será de cloreto de prata.
18-Uma solução saturada de base, representada por X(OH)2, tem pH=10 a 25O C. Qual o produto de solubilidade do X(OH)2?