

São misturas homogêneas (aspecto uniforme) que apresenta dois
componentes principais, chamado de soluto e solvente.
Podemos ter vários tipos de soluções. Observe:
q
Solução sólida: ligas metálicas, tais como
bronze (Cu+Sn) e latão (Cu+Zn);
q
Solução gasosa: ar atmosférico;
q
Solução liquida: Podemos ter um sólido
dissolvido em um líquido, ou então, dois líquidos dissolvidos entre si. São
formados por uma ou mais substâncias dissolvidas (soluto) num líquido
(solvente). Seus componentes não podem ser separados por filtração. Sua
separação pode ocorrer usando outros processos físicos, tais como a destilação.
O
soluto sempre irá representar o componente que se encontra dissolvido em uma
outra substância que, no caso, será o solvente. Ainda com base na definição,
é possível dizer que o soluto sempre será a espécie que se encontra em menor
quantidade.
Coeficiente de solubilidade: é a quantidade de soluto que se
encontra dissolvido em uma quantidade padrão (mínima) de solvente a uma
determinada temperatura. Normalmente a quantidade de solvente mais usada é de
100g.
q
Solução saturada: é toda solução em que o
soluto atinge o seu coeficiente de solubilidade na temperatura fornecida;
q
Solução saturada com corpo de fundo:
é toda solução em que a quantidade de soluto dissolvida ultrapassa o
coeficiente de solubilidade (ponto de saturação);
q
Solução supersaturada:
é quando excede a quantidade máxima de soluto a ser dissolvida de acordo com o
coeficiente de solubilidade, sendo que o excesso de soluto é dissolvido por
variação de temperatura.
q
Solução insaturada: é toda solução em que a
quantidade de soluto dissolvida não
ultrapassa o coeficiente de solubilidade (ponto de saturação).
Quando
é conhecido o coeficiente de solubilidade de um soluto em várias temperaturas,
é possível apresentar os seus
valores em um gráfico que relaciona a solubilidade com a temperatura, que
passaremos a denominar de curva de solubilidade.
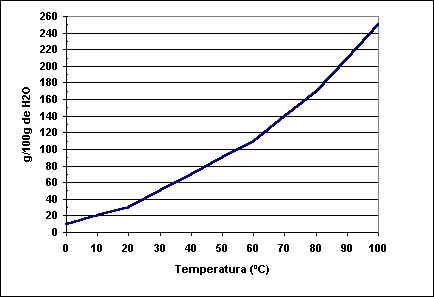
Analisando o gráfico, é possível perceber que qualquer ponto situado
à esquerda da curva irá representar a condição de supersaturação e
qualquer ponto à direita representará a condição de insaturação. Além
disso, é importante observar que todo ponto situado na curva indica que a solução
está saturada.
A
tabela a seguir refere-se a solubilidade de uma determinada substância nas
respectivas temperaturas:
|
Temperatura
(ºC) |
g/100g
de H2O |
|
30 |
60 |
|
50 |
70 |
|
70 |
90 |
Uma
solução saturada desse sal foi preparada, utilizando-se 200g de água a 70O
C e a seguir foi resfriada a 30O C. com base nessas informações,
responda:
1.
Qual a massa de precipitado que irá se formar?
2.
Qual a massa da solução final?
3.
Para dissolver 40g dessa substância a 50O C, qual deverá ser
a massa de água necessária?
4.
(Fuvest-SP) Quatro tubos contêm 20 mL de água cada um a 20O
C. Coloca-se nesses tubos dicromato de potássio
(K2Cr2O7) nas seguintes quantidades:
|
|
Tubo A |
Tubo B |
Tubo C |
Tubo D |
|
Massa
de K2Cr2O7 |
1,0 |
3,0 |
5,0 |
7,0 |
A solubilidade do sal, a 20O C, é igual a 12,5g/100 mL de água.
Após agitação, em quais tubos coexistem, nessa temperatura, solução
saturada e fase sólida?
5.
(PUC-RJ) A tabela abaixo mostra a solubilidade de vários sais, à
temperatura ambiente, em g/100 mL:
|
Substância
|
g/100
mL de H2O |
|
Nitrato
de prata |
260 |
|
Sulfato
de alumínio |
160 |
|
Cloreto
de sódio |
36 |
|
Nitrato
de potássio |
52 |
|
Brometo
de potássio |
64 |
Se 25 mL de uma solução saturada de um desses sais forem completamente
evaporados, e o resíduo sólido pesou 13g, qual era o sal? R:nitrato de potássio
6.
(UEL-PR) A 10O C a solubilidade do nitrato de potássio é de
20,0g/100g de H2O. Uma solução contendo 18,0g de nitrato de potássio
em 50,0g de água a 25O C é resfriada a 10O C. Quantos
gramas do sal permanecem dissolvidos na água?
7.
(FEI-SP) Tem-se 500g de uma solução aquosa de sacarose (C12H22O11),
saturada a 50O C. Qual a massa de
cristais que se separam da solução, quando ela é
resfriada até 30O C? R:55,6
Dados:
Cs a 30O C = 220g/100g de H2O e
Cs a 50O C = 260g/100g de H2O
8.
(EEM-SP) Evapora-se completamente a água de 40g de solução de nitrato
de prata, saturada, sem corpo de fundo, e obtêm-se 15g de resíduo sólido.
Qual é o coeficiente de solubilidade do nitrato de prata para 100g de água na
temperatura da solução inicial ? R:Cs=60g/100g H2O
Unidades de concentração das soluções
De acordo com a IUPAC, a quantidade de matéria deve ser expressa em
mols. Nas soluções, a concentração pode ser determinada em mols, massa ou
volume. O que realmente importa é estabelecer uma comparação entre a
quantidade de soluto e a quantidade de solvente ou de solução.
Para trabalhar as unidades de concentração adotaremos alguns números
como índices para representar soluto, solvente e solução.
1-soluto
2-solvente
sem
índice – solução
v
Concentração
comum (C): Determina
a quantidade de massa de soluto (m1) em gramas por unidade de volume
(V) de solução (L).
![]()
9.
Qual a concentração de uma solução contendo 40g de cloreto de sódio
dissolvidos em 250 mL de solução? R:160
10.
Uma solução foi preparada adicionando-se 40g de hidróxido de sódio em
água suficiente para produzir 200 mL de solução. Calcule a concentração
comum dessa solução. R:200
11. Calcule
a concentração comum de uma solução de nitrato de prata, sabendo que ela
encerra 120g do sal em 600 cm3 de
solução. R:200
12. Determine
a massa de ácido nítrico, em gramas, necessária
para a preparação de 150 mL de uma solução de
concentração 50g/L. R:7,5g
13. (Faap-SP) Calcule a concentração, em g/L, de uma solução aquosa de nitrato de sódio que contêm 30g de sal em 400 mL de solução. R:7,5
14.
(Mack-SP) Qual a concentração, em g/L, da solução obtida ao se
dissolverem 4g de cloreto de sódio em 50 cm3 de
solução? R:80
15.
São dissolvidos 24g de sacarose em água suficiente para 500mL de solução.
Qual é a concentração comum dessa solução? R:48
16.
Calcule a concentração comum de uma solução que apresenta volume de
800mL e contém 80g de soluto. R:100
17.
(PUCCamp-SP) Evapora-se totalmente o solvente de 250 mL de uma solução
aquosa de cloreto de magnésio de concentração 8,0g/L. Quantos gramas de
soluto são obtidos? R:2
18.
São dissolvidos 200g de cloreto de sódio em água suficiente para 2
litros de solução. qual é a concentração comum dessa solução? R:100
19.
300g de açúcar foram adicionados a uma certa quantidade de água,
obtendo-se uma solução 60g/L. Qual o volume dessa solução, em mL?
R:5000
20.
A concentração comum de uma solução é de 20g/L. Determine o volume,
em mL, dessa solução, sabendo que ela contém 75g de soluto. R:3750
21.
(UFSM-RS) O derramamento de óleo nos cursos d’água forma uma película
que dificulta a absorção de oxigênio, o que provoca a destruição de algas e
plânctons, prejudicando a alimentação dos peixes. De acordo com alguns órgãos
ambientais, o limite máximo de óleo na água é de 30mg/L. Com base nesse parâmetro,
quantos gramas de óleo poderão estar presentes em 1m3 de água, sem
comprometer o ecossistema? R:30
22.
Determine a massa de NaOH, em gramas, dissolvido em água suficiente para
300mL de solução, cuja concentração comum é de 700g/L. R:210
23.
Um frasco de laboratório contém 2,0 L de uma solução aquosa de NaCl.
A massa do sal dissolvida na solução é de 120g. Que volume, em L, deve ser
retirado da solução inicial para que se obtenham 30g de sal dissolvido? R:0,5
24.
(USJT-SP) O oxalato de cálcio é encontrado nas folhas de espinafre, nas
sementes do tomate, e é um dos constituintes das pedras formadas nos rins (cálculo
renal). Uma amostra (alíquota) de 25 cm3 de uma solução aquosa de
oxalato de cálcio contém 0,2625g desse sal. Qual é a concentração comum de
oxalato nessa solução? R:10,5
v
Título
ou concentração em massa/massa (T): Determina a quantidade de massa de soluto (m1) em
uma determinada quantidade de massa de solução (m). Não apresenta unidade.
![]()
![]()
25.
Calcular a porcentagem, em massa, de uma solução formada, quando foram
utilizados 40g de cloreto de sódio para serem dissolvidos em 60g de água. R:
40%
26.
Uma solução aquosa de hidróxido de sódio é preparada, misturando-se
20g de soluto com 140g de solvente. Qual a porcentagem, em massa, do soluto na
solução? R: 12.5%
27.
(F.F.O.Diamantina-MG) Quantos gramas de água são necessários, a fim de
preparar uma solução a 20% em peso,usando 80g de soluto? R: 320g
28. (PUC-Camp-SP) Tem-se um frasco de soro glicosado, a 5% (solução aquosa de 5% em massa de glicose). Para preparar 1 kg desse soro, quantos gramas de glicose devem ser dissolvidos em água? R: 50g
29.
(E.E.Mauá-SP) Uma solução de um dado soluto foi preparada a partir de
160g de água. Se o título da solução é 0,2, calcule
a massa do soluto. R: 40g
30.
A análise revelou que um vinho contém 48 mL de álcool em cada caneca
de 300 mL. Qual o título em volume desse vinho? E em porcentagem? R: 0,16 e 16%
v
Concentração
molar ou molaridade (Mr): É a relação entre o número de mols do soluto (n1)
e o volume (V), em litros, da solução.
![]()
31.
Quantos litros de solução de cloreto de sódio a 0,2M podem ser
preparados a partir de 468g de cloreto de sódio? R: 40L
32.
Qual a quantidade de soluto, em gramas, presente em 100mL de uma solução
1M de HCl? R: 3,65g
33.
(UFRN) Qual a concentração molar
da glicose (C6H12O6) numa solução aquosa que
contém 9g de soluto em 500mL de solução? R: 0,1M
34.
Qual a concentração molar de uma solução aquosa de ácido sulfúrico,
sabendo-se que foram dissolvidos 49g do ácido em 2L de solução? R: 0,25M
35.
(UFAC) Qual a molaridade de uma solução aquosa contendo 36,5g de ácido
clorídrico (HCl) dissolvidos em água até completar 2L de solução? R:0,5M
36.
Para preparar uma solução de concentração 0,2 mol/L, usando 15g de
iodeto de sódio (NaI), qual deverá ser o volume dessa solução, em litros? R:
0,5L
37.
Ao dissolver 5,85g de cloreto de sódio em água suficiente para 0,5L de
solução, calcule a concentração molar dessa solução? R: 0,2M
38.
No preparo de uma solução alvejante de tinturaria, 521,5g de
hipoclorito de sódio (NaClO) são dissolvidos em água suficiente para 10L de
solução. Qual é a concentração molar da solução obtida? R: 0,7
39.
(Vunesp-SP) Dissolveram-se 2,48g de tiossulfato de sódio penta-hidratado
(Na2S2O3.5H2O) em água suficiente
para se obter 100cm3 de solução. Qual a molaridade dessa solução?
R: 0,1M
40.
O rótulo de uma garrafa de água mineral, distribuída para consumo,
informa que ela contém, principalmente, 696,35 mg/L de bicarbonato de sódio
(NaHCO3), além de outros componentes. Qual a concentração molar de
bicarbonato de sódio? R: 0,008M
41.
(UFCE) Qual a molaridade de uma solução aquosa de etanol (C2H6O),
de concentração igual a 9,2g/L? R: 0,2M
42.
Em um laboratório, tem-se um frasco com o seguinte rótulo: NaOH 5M. Que
volume dessa solução, em mL, contém massa igual a 20g de NaOH? R: 100mL
43.
(Unicamp-SP) Em um frasco A há 100mL de uma solução aquosa 0,1M de
glicose (C6H12O6). Em outro frasco B há 100mL
de uma solução 0,1M de cianeto de potássio (KCN). Quantos átomos de carbono
há em cada frasco? R: A: 3,612x1022 e B: 6,02x1021
Ø
Dependendo do sistema que estamos investigando, a concentração
molar pode ser dada em função de um cátion ou de um ânion. Considere a
seguinte equação de dissociação iônica de uma solução 0,2M de sulfato de
alumínio : Al2(SO4)3 à
2Al+3 + 3SO4-2. Como em cada litro, há 0,2 mol
de sal, as quantidades de mol de cátions e ânions serão proporcionais aos
coeficientes da equação de dissociação.
Al2(SO4)3 à
2Al+3 +
3SO4-2
Proporção dos coeficientes:
1mol 2mols
3mols
Em cada litro:
0,2M 0,4M
0,6M
44.
500mL de solução contém 40g de sulfato férrico – Fe2(SO4)3
– totalmente dissociado. Calcule a molaridade dos íons,
em mol/L. R: 0,4M e 0,6M
45.
(Mack-SP) Qual a molaridade do íon Mg+2 e a do PO4-3
numa solução 0,4M de ortofosfato de magnésio – Mg3(PO4)2?
R: 1,2M e 0,8M
46.
Uma solução aquosa de cloreto de cálcio (CaCl2), totalmente
dissociado, foi preparada pela dissolução de 11,1g do referido soluto em água
suficiente para 2L de solução. Qual a concentração molar dos íons na solução?
R: 0,05M e 0,1M
v
Fração
molar do soluto (X1): É a relação entre o número de
mols do soluto (n1) e o número de mols da solução (n2)
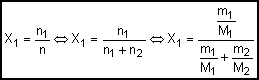
v
Fração
molar do solvente (X2): É a relação entre o número de
mols do solvente (n2) e o número de mols da solução (n2)
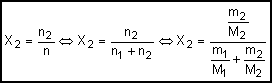
47.
Calcular as frações molares do soluto e do solvente em uma solução
que contém 117g de cloreto de sódio dissolvidos em 324g de água. R: 0,1 e 0,9
48.
(FURRN adaptado) Qual a fração molar do soluto e do solvente de uma
solução preparada tomando-se 3 mols de glicose e 97 mols de água? R: 0,03 e
0,97
49.
Qual a fração molar do componente B numa mistura contendo 4g de A
(M=20g/mol) e 8,4g de B (M=28g/mol)? R: 0,6
50.
(U.F.Fluminense-RJ) Uma solução contém 18g de glicose (C6H12O6),
24,0g de ácido acético (C2H4O2) e
81,0g de água. Qual a fração molar do ácido acético na solução? R: 0,08
51.
(Faap-SP) Uma solução aquosa de NaCl apresenta 11,7% em peso de soluto.
Determine as frações molares do soluto e do solvente nessa solução. R:
0,0392 e 0,9608
52.
Determine as frações molares do soluto e do solvente numa solução que
foi preparada dissolvendo-se 98g de ácido sulfúrico em 162g de água. R: 0,1 e
0,9
v
Concentração
molal ou molalidade (W): É a relação entre o número de mols do soluto (n1)
e a massa, em kg, do solvente.
![]()
53.
Calcular a molalidade da solução formada utilizando-se 171g de sacarose
(C12H22O11) dissolvidos em 400g de água. R:
1,25
54.
Determinar a massa de água, em gramas,
que deve ser utilizada para dissolver 0,2 mol de cloreto de sódio
e originar uma solução 0,4 molal. R: 500g
55.
Qual a molalidade de uma solução que contém 100g de brometo de cálcio
– CaBr2 – em 250g de água? R: 2
56.
Uma solução 0,2 molal de glicose foi preparada utilizando-se 500g de água.
Qual a massa de glicose presente nessa solução? R: 18g
57.
(PUC-MG) Quando 39,2g de ácido sulfúrico são dissolvidos em 200mL de
água, obtém-se uma solução de volume igual a 220 mL.Qual a molalidade e a
molaridade dessa solução?R: 2W e
1,8M
v
Relação
entre as unidades de concentração e densidade
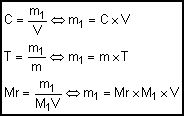
v
Relação
entre concentração comum e título
|
|
|
v
Relação
entre molaridade e título
|
|
|
v
Relação
entre molaridade e concentração comum
|
|
|
v
Relação
final
|
|
58.
Uma solução de ácido clorídrico, de densidade 1,2 kg/L, contém 40%
em massa, de HCl. Qual a massa de água,
em gramas, existente em 1 L de solução do ácido, nessa concentração?
R:720g
59.
(PUC-PR) A solução aquosa
de NaOH (soda cáustica) é um produto químico muito utilizado. Uma determinada
indústria necessitou usar uma solução com 20% em massa de hidróxido de sódio,
que apresenta uma densidade de 1,2 kg/L. Qual a molaridade da solução? R: 6M
60.
O soro caseiro, recomendado para evitar a desidratação infantil,
consiste em uma solução aquosa de cloreto de sódio (3,5 g/L) e de sacarose
(11 g/L). Qual a concentração molar
do cloreto de sódio nessa solução? R: 0,06M
61.
Num refrigerante do tipo “cola”, foi feita uma análise química que
determinou uma concentração de íons fosfato (PO4-3)
igual a 0,15 g/L. Qual a concentração de íons fosfato, em mols por litro,
nesse refrigerante? R: 1,57x10-3M
62.
(Cesgranrio-RJ) Num exame
laboratorial, foi recolhida uma amostra de sangue, sendo o plasma separado dos
eritrócitos, ou seja, deles
isolado antes que qualquer modificação fosse
feita na concentração de gás carbônico. Qual a concentração em g/L,
sabendo-se que a concentração de CO2, neste plasma, foi de 0,025
mol/L? R: 1,1
63.
Considerando que o conteúdo de ácido acético existente no vinagre é
de aproximadamente 3% em peso e que a densidade do vinagre é 1 g/mL, qual a
molaridade do ácido acético existente em um litro de vinagre? R: 0,5M
v
Diluição
de soluções: Diluir
uma solução nada mais é do que acrescentar solvente a essa solução,
alterando a relação soluto/solvente. Considerando que a massa do soluto é a
mesma, alterando apenas o volume da solução, podemos ter as seguintes fórmulas:
|
|
|
|
É
importante considerar que em toda diluição a concentração final será sempre
menor que a concentração inicial.
64. A
uma amostra de 100 mL de hidróxido de sódio 20g/L foi adicionada água
suficiente para completar 500 mL. Qual
a concentração,
em g/L, dessa nova solução? R: 4 g/L
65.
(Vunesp-SP adaptado) Qual o volume, em mL,
de uma solução de ácido
sulfúrico 15 mol/L necessário para preparar 500 mL de uma solução aquosa de
ácido sulfúrico de concentração 3 M? R:100 mL
66.
Qual a molaridade de uma solução de hidróxido de sódio, que foi
obtida adicionando-se 80 mL de água a 20 mL de outra solução de concentração
0,1M? R: 0,02M
67.
(Osec-SP) Preparam-se 100 mL de uma solução contendo 1 mol de cloreto
de potássio (KCl). Tomaram-se, então, 50 mL dessa solução e juntaram-se 450
mL de água. Qual a molaridade da solução final? R: 1M
68.
(PUC-MG) Uma solução de hidróxido de potássio (KOH) foi preparada
dissolvendo-se 16,8g da base em água suficiente para 200 mL de solução. Dessa
solução, qual o volume que deve ser diluído a 300 mL, para que a molaridade
seja 1/3 da
solução original? R: 100 mL
69.
(UFRN) Qual o volume de água, em mL, que deve ser adicionado a 80 mL de
solução aquosa 0,1M de uréia, para que a solução resultante seja 0,08M? R:
20
70. Em 300 mL de uma solução de cloreto de sódio 0,2M, foi adicionada água suficiente para fazer um litro de solução. Qual a molaridade da solução final? R: 0,06M
71.
(Cesgranrio-RJ) Uma solução 0,05M de sacarose, contida em um béquer,
perde água por evaporação até restar um volume de 100 mL, passando a
concentração para 0,5M. Qual o volume de água evaporado? R: 900 mL
v
Mistura
de duas soluções de mesmos solutos
Quando
são misturadas duas soluções formadas pelo mesmo soluto e pelo mesmo
solvente, observe que eles se comportam como se ocorresse uma diluição, sendo
que a solução resultante ficará entre os valores das duas outras soluções.
|
|
|
|
72.
Duas amostras de soluções aquosas de hidróxido de sódio – uma de
volume 200 mL e 0,15M e outra de volume 0,1L e 0,030M – foram misturadas. Qual
a molaridade da solução final? R:0,2M
73.
500 mL de uma solução 1M de ácido sulfúrico e 1500 mL de uma outra
solução 2M do mesmo ácido foram misturados e o volume final foi completado a
2,5L pela adição de água. Qual a molaridade da solução resultante? R: 1,4M
74.
(Fesp-SP) Qual o volume, em mL, de uma solução de hidróxido de sódio
1,5M, que deve ser misturada a 300 mL de uma solução 2M da mesma base, a fim
de torná-la solução 1,8M? R: 200 mL
75.
300 mL de solução de hidróxido de amônio, com concentração 3 g/L,
foram misturados com 200 mL de outra solução de mesma base, de concentração
desconhecida. Após a mistura, foi obtida uma solução final contendo 4 g/L.
Indique, respectivamente, quantos gramas de soluto há na primeira solução e
qual o valor da concentração desconhecida? R: 0,9g e 2,22 g/L
76.
(UFAC) Qual a molaridade de uma solução de hidróxido de sódio formado
pela mistura de 60 mL de solução a 5M com 300 mL de solução
a 2M? R: 2,5M
77.
Qual deve ser a massa de solução de hidróxido de sódio cujo título
é igual a 0,12, que deve ser adicionada a 200g de outra solução de NaOH, de título
igual a 0,20, para que seja obtida uma solução de NaOH de título igual a
0,18? R: 66,66g
v
Mistura
de duas soluções de solutos diferentes que não reagem entre si
Devemos
considerar cada soluto de modo independente na solução final – isto é, como
se o outro soluto não existisse. Desse modo, tudo se passa como se cada solução
inicial sofresse uma diluição, partindo de seu volume inicial e atingindo o
volume da mistura. Sendo assim, podemos aplicar as fórmulas de diluição:
|
|
|
|
Lembre-se
que ao calcular a concentração de íons após a mistura, deveremos considerar
cada íon independente e somar aqueles que repetem na mistura.
78.
Misturando-se 100 mL de cloreto de sódio 70g/L e 200 mL de cloreto de
potássio 40g/L, quais serão as concentrações, em g/L, dessas duas substâncias,
na solução final? R: 23,3 e 26,6
79.
(UFRN) Quais as concentrações de Na+, K+, Cl-,
de uma solução formada a partir de 100 mL de solução aquosa de cloreto
de sódio 0,1M e 100 mL de solução aquosa de cloreto de potássio 0,1M?
R: 0,05M; 0,05M e 0,10M
80.
Misturando-se 50 mL de solução 5M de nitrato de sódio (NaNO3)
com 150 mL de solução 2M de cloreto de potássio, quais serão as molaridades
dessas duas substâncias, na solução final? R:1,25M e 1,5M
81.
(UFRJ) Misturou-se 100 mL de solução aquosa de cloreto de potássio 0,1M com 100 mL de solução aquosa de cloreto
de magnésio 0,1M. Quais as concentrações de K+, Mg+2,
Cl-, na solução resultante? R: 0,05M; 0,05M e 0,15M
v
Mistura
de duas soluções de solutos diferentes que reagem entre si
Havendo
reação química e não uma simples mistura, devemos resolver com auxílio do cálculo
estequiométrico e observar se não há excesso de um participante na reação.
82.
Juntando-se 200 mL de ácido sulfúrico 0,3M e 100 mL de hidróxido de
potássio 1,2M. Pergunta-se quais serão as molaridades da solução final em
relação ao ácido, à base e ao sal formado.
H2SO4
+ 2KOH à
K2SO4 +
2H2O
1mol
2mols
1 mol 2mols
Calculando
o número de mols de cada reagente:
|
|
|
|
|
H2SO4
+ 2KOH
à
K2SO4
+ 2H2O
1mol
2mols
1 mol
2mols
0,06mol
0,12mol 0,06mol 0,12mol |
||
|
Molaridade final do H2SO4
è
zero
Molaridade final do KOH
è
zero |
||
|
Molaridade final do K2SO4 |
|
|
83.
Qual será a molaridade da solução final com relação ao sal formado,
quando junta-se 0,3L de ácido clorídrico 0,4M e 0,2L de hidróxido de sódio
0,6M? R: 0,24M
84.
(FFC-BA) A 1L de solução 0,1M de hidróxido de sódio
adiciona-se 1L de solução de ácido clorídrico 0,1M. Qual será o
valor da massa sólida quando a solução resultante for levada à secura até
que a mesma seja formada? R: 5,85g
85.
(UFRN) Cada cm3 de leite de magnésia contém 0,08g de Mg(OH)2.
Quantos mols de HCl do suco gástrico são neutralizados quando uma pessoa
ingere 15cm3 de leite de magnésia? R: 4x10-2 mol.
86. (UFF-RJ) Se 40 ml de HCl 1,6M e 60 mL de NaOH 2M são misturados, quais concentrações molares de Na+, Cl- e OH- são encontradas, respectivamente, na solução resultante? R: 1,2; 0,64; 0,56.