

Fenômeno Físico e Químico
Fenômeno Físico é aquele que não altera a natureza do material que sofre o fenômeno (é qualquer mudança que ocorre num determinado sistema). Toda mudança de estado físico é um fenômeno físico. Também podemos afirmar que o amassamento de uma lata, a mudança de posição de uma pedra, a passagem de uma corrente elétrica por um fio.
Mudanças de estado físico
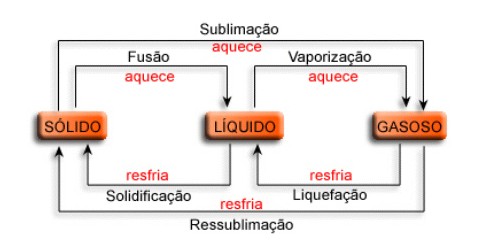
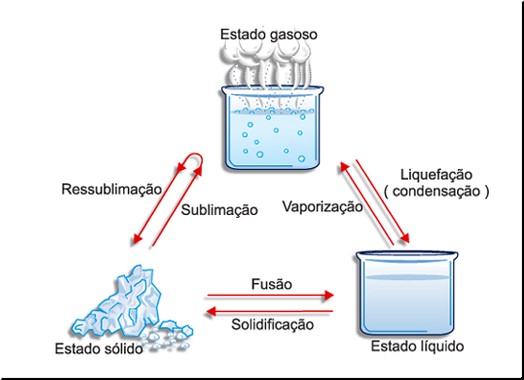
Cada transformação do estado físico tem uma denominação característica, o que podemos representar através de equações químicas, ou então através de frases:
Pb(s) à
Pb(L) - indica que o chumbo sólido está sendo transformado
em líquido, o que indica uma fusão (passagem do estado sólido para o estado
líquido);
H2O(L) à
H2O(s) - indica que a água líquida está sendo
transformada em sólido (gelo), o que indica uma solidificação (passagem do
estado líquido para o estado sólido);
CO2(s) à
CO2(G) - indica que gás carbônico sólido (gelo seco) está
sendo transformada em gasoso, o que indica uma sublimação (passagem do estado
sólido para o estado gasoso);
nitrogênio gasoso em líquido - indica que houve uma liquefação, pois o
nitrogênio passou de gasoso para líquido.
Uma mudança de estado pode ser representado através de um gráfico:
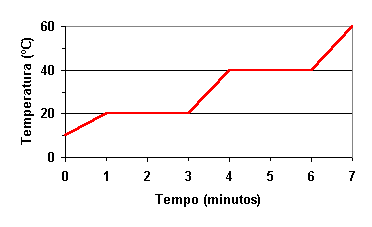
É um gráfico de aquecimento, pois a temperatura sobe no decorrer do tempo. Podemos retirar algumas informações importantes observando o gráfico:
Trata-se
de uma substância pura (apresenta ponto de fusão e ebulição constante).
Inicialmente
a substância estava sólida e a temperatura inicial era de 10ºC.
No
intervalo de 1 a 3 minutos, a temperatura permaneceu constante (20ºC). Isso
indica que a substância estava mudando de estado físico (indo de sólido para
líquido).
De
3 a 4 minutos, ocorreu o aquecimento do líquido.
No
intervalo de 4 a 6 minutos, a substância passou de líquido para gasoso (a
temperatura era de 40ºC).
De
6 a 7 minutos, continuou o aquecimento do gás.
Podemos ter também um gráfico de resfriamento de uma substância líquida (não necessariamente ela tem que iniciar no gasoso. Isso vai depender do enunciado):
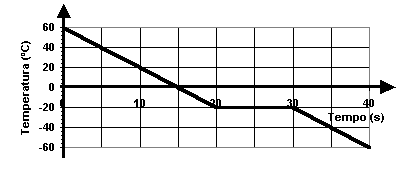
É um gráfico de resfriamento, pois a temperatura diminui no decorrer do tempo. Podemos retirar algumas informações importantes observando o gráfico:
Inicialmente
a substância estava líquida e a temperatura inicial era de 60ºC. Durante
20 segundos, ela foi sendo resfriada até chegar a -20ºC.
No
intervalo de 20 a 30 segundos, a temperatura permaneceu constante (-20ºC). Isso
indica que a substância estava mudando de estado físico (indo de líquido para
sólido).
De
30 a 40 segundos, ocorreu o resfriamento do sólido.
Podemos ter também uma tabela com substâncias desconhecidas (A, B, C, D e E) e teremos que descobrir o seu estado físico em determinada temperatura. Observe o exemplo:
|
Substância |
ponto
de fusão (ºC) |
Ponto
de ebulição (ºC) |
|
A |
-16 |
80 |
|
B |
50 |
80 |
|
C |
-12 |
48 |
|
D |
-100 |
16 |
|
E |
25 |
55 |
Qual o estado físico das substâncias desconhecidas a 20ºC?
Inicialmente, vamos analisar as informações da tabela.
O que significa ponto de fusão? É a passagem do estado sólido para o estado líquido. Isso indica que antes do valor a temperatura era sólida.
O que significa ponto de ebulição? É a passagem do estado líquido para o estado gasoso. Isso indica que antes do valor a temperatura era líquida.
Basta riscar uma linha, colocar o ponto de fusão e o ponto de ebulição e observar a temperatura que está sendo solicitada

Analisando cada substância separadamente:
Substância A: antes de -16ºC ela era sólida. Depois de 80ºC ela é gasosa. Isso indica que a 20ºC, ela é líquida.
Substância B: antes de 50ºC ela era sólida. Depois de 80ºC ela é gasosa. Isso indica que a 20ºC, ela é sólida.
Substância C: antes de -12ºC ela era sólida. Depois de 48ºC ela é gasosa. Isso indica que a 20ºC, ela é líquida.
Substância D: antes de -100ºC ela era sólida. Depois de 16ºC ela é gasosa. Isso indica que a 20ºC, ela é gasosa.
Substância E: antes de 25ºC ela era sólida. Depois de 55ºC ela é gasosa. Isso indica que a 20ºC, ela é sólida.
Veja o que podemos fazer na tabela diretamente (coloque a temperatura procurada - 20ºC - e veja o estado físico na própria tabela:

O resultado sai mais rapidamente:
Substância A : líquida;
Substância B : sólida;
Substância C : líquida;
Substância D : gasosa;
Substância E : sólida;
Fenômeno Químico é aquele que altera a natureza do material que sofre o fenômeno. O material do estado inicial "desaparece" e no seu lugar surge pelo menos uma nova substância. São fenômenos químicos: combustão de qualquer material, destruição da camada de ozônio, formação da chuva ácida, o apodrecimento de qualquer fruta, a formação de ferrugem (oxidação) numa placa de ferro etc.
Uma reação química representa um fenômeno químico, sempre que os produtos sejam diferentes dos reagentes. É importante lembrar que uma reação química é a transformação de uma ou mais substâncias em novas substâncias. As iniciais são destruídas e originam novos tipos de substâncias, ocorrendo, assim, mudanças nos tipos de moléculas. Todo fenômeno químico é uma reação química.
Os reagentes são as substâncias iniciais, ou seja, que sofrem o fenômeno químico. Os reagentes são consumidos durante o processo de transformação.
Os produtos são as substâncias finais, ou seja, são formadas no lugar dos reagentes (que desaparecem). São o resultado da transformação química ocorrida.
![]()
Equação química é a representação gráfica das reações químicas utilizando fórmulas químicas. Nelas, os reagentes são colocados à esquerda (1º membro) e os produtos à direita (2º membro). Entre ambos utiliza-se uma seta, orientada dos reagentes para os produtos. Os números que precedem as fórmulas das substâncias recebem o nome de coeficientes estequiométricos e indicam a proporção entre o número de moléculas reagentes e produzidas.
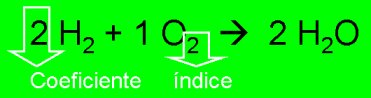
Observando o exemplo acima, podemos ver:
O elemento hidrogênio (H) e o elemento oxigênio participam da reação através das substâncias simples H2 e O2. São duas moléculas de H2 para uma molécula de O2. Durante o processo serão consumidas, formando uma substância composta (H2O), que estará presente com duas moléculas.
Os coeficientes são necessários para o balanceamento da equação, ou seja, para que se iguale o número de átomos de cada elemento em ambos os membros da equação química. Voltando ao exemplo acima, observe que teremos:
4
átomos de hidrogênio no primeiro e segundo membros da equação;
2
átomos de oxigênio no primeiro e segundo membros da equação.
Veja que ocorreu uma rearranjo de átomos:
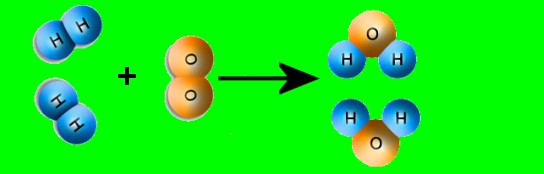
Para que ocorra uma reação química, é preciso desfazer as moléculas dos reagentes (H2 e O2) e dispor seus átomos segundo uma nova recombinação. Ocorrerá a formação de novos tipos de moléculas (H2O) e, conseqüentemente, de novas substâncias. No exemplo acima, veja que as substâncias simples (H2 e O2) separaram, formando uma substância composta (H2O).
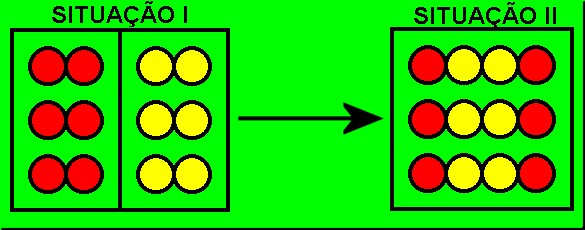
Veja que os reagentes (situação I) eram substâncias simples (formadas por um só tipo de elemento químico) e passaram a ser substâncias compostas (situação II), o que caracteriza que foram modificados, ocorrendo uma reação química.
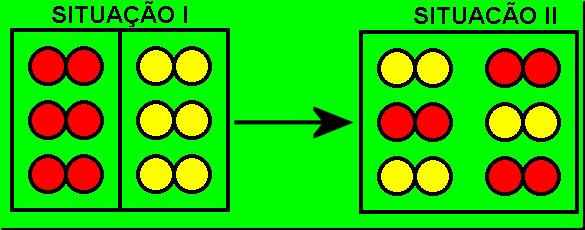
Veja que os reagentes (situação I) eram substâncias simples (formadas por um só tipo de elemento químico) e continuam sendo, pois estão apenas misturadas (permanecem intactas utilizando todo o ambiente).
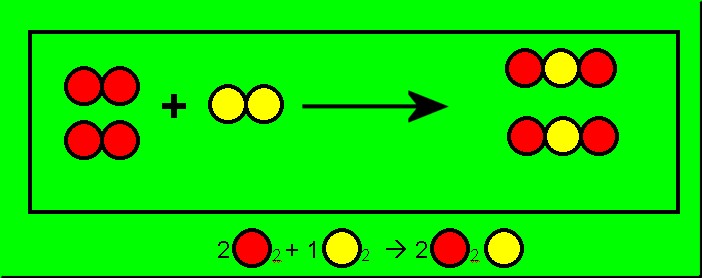
Representamos os elementos, utilizando o modelo de bolas, para demonstrar a equação química. Veja como fica mais fácil trabalhar com a segunda representação.
Classificação de reações químicas
Síntese
ou adição: Temos mais de um reagente e só um produto. Genericamente,
podemos afirmar que: A + B à
AB
Ex: N2 + 3H2 à 2NH3
Análise
ou decomposição: Temos apenas um reagente e vários produtos.
Genericamente, podemos afirmar que: AB à
A + B
Ex: CaCO3 à CaO + CO2
Simples
troca ou deslocamento: Temos a mesma quantidade de reagentes e produtos. O
que diferencia é uma substância simples aparece tanto nos reagentes como nos
produtos. Genericamente, podemos afirmar que:
AB + C à AC + B ou AB + C à CB + A
Ex: Fe + HCl à FeCl2 + H2
Dupla
troca ou dupla substituição: Temos
a mesma quantidade de reagentes e produtos. O que diferencia é que todos são
substâncias compostas tanto nos reagentes como nos produtos. Genericamente,
podemos afirmar que:
AB + CD à AD + CB
Ex: HCl + NaOH à NaCl + H2O