

Funções Químicas
Todos
os materiais, substâncias puras ou misturas, são formadas por átomos. Assim
como os compostos inorgânicos que compõem a atmosfera, a hidrosfera e a
litosfera são constituídas por ácidos, bases, sais, óxidos e hidretos.
No
século XIX, o químico sueco Svante August Arrhenius pesquisou a condutividade
elétrica das substâncias na presença de água e apresentou um conceito para
ácidos e bases, que foi denominado de Teoria Eletrolítica de Arrhenius. Ele
verificou que determinadas soluções aquosas conduziam corrente elétrica (soluções
eletrolíticas) e outras, não (soluções não-eletrolíticas).
Para
justificar esse comportamento das substâncias em água, foi proposta por
Arrhenius a teoria da dissociação eletrolítica. Por essa teoria, nas soluções
eletrolíticas, as substâncias dissolvidas em água se dividem em partículas
menores chamadas de íons (que em grego significa viajante).
Ácidos:
É todo composto que, dissolvido em água, gera como cátion o H+ ou
H3O+. Observe as equações de ionizações totais dos ácidos
clorídrico(HCl) e nítrico (HNO3)
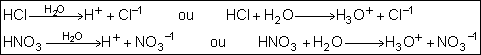
Demonstre
as equações de ionização dos seguintes ácidos:
a)
HClO
b)
HBr
c)
HCN
d)
HF
e)
HCN
f)
HNO2
Formulação
de um ácido:
basta acrescentar hidrogênio na quantidade da carga negativa do radical,
lembrando sempre que o hidrogênio virá sempre antes do radical negativo,
fazendo com que as cargas elétricas se anulem.
|
|
|
|
|
2.
Escreva
a fórmula do ácido, conforme o exemplo:
|
AlO2-1 |
HAlO2 |
CO3-2 |
H2CO3 |
|
BiO3-1 |
|
CrO4-2 |
|
|
Br-1 |
|
Cr2O7-2 |
|
|
BrO-1 |
|
SnO3-2 |
|
|
BrO3-1 |
|
SnO2-2 |
|
|
BrO4-1 |
|
HPO3-2 |
|
|
Cl-1 |
|
MnO4-2 |
|
|
ClO-1 |
|
SiO3-2 |
|
|
ClO2-1 |
|
C2O4-2 |
|
|
ClO3-1 |
|
S-2 |
|
|
ClO4-1 |
|
SO4-2 |
|
|
CN-1 |
|
SO3-2 |
|
|
F-1 |
|
S2O3-2 |
|
|
H2PO2-1 |
|
ZnO2-2 |
|
|
I-1 |
|
SbO4-3 |
|
|
IO-1 |
|
SbO3-3 |
|
|
IO2-1 |
|
AsO4-3 |
|
|
IO3-1 |
|
AsO3-3 |
|
|
IO4-1 |
|
BO3-3 |
|
|
MnO4-1 |
|
Fe(CN)6-3 |
|
|
NO2-1 |
|
PO4-3 |
|
|
NO3-1 |
|
Fe(CN)6-4 |
|
|
OCN-1 |
|
SiO4-4 |
|
|
PO3-1 |
|
Sb2O7-4 |
|
|
SCN-1 |
|
As2O7-4 |
|
|
HCO3-1 |
|
P2O7-4 |
|
|
HSO4-1 |
|
P2O5-4 |
|
Para
dar nome a um ácido, utilize uma tabela de radicais negativos, que foi construída,
utilizando os seguintes conceitos:
Todos os ácidos que não apresentam oxigênio (classificados como hidrácidos), apresentam o sufixo ídrico;
O
restante pode apresentar os sufixos ico ou oso, dependendo do número de
oxidação (carga elétrica ) que ele apresenta.
|
Radical |
ácido |
Radical |
ácido |
|
AlO2-1 |
Alumínico |
CO3-2 |
Carbônico |
|
BiO3-1 |
Bismútico |
CrO4-2 |
Crômico |
|
Br-1 |
Bromídrico |
Cr2O7-2 |
Dicrômico |
|
BrO-1 |
hipobromoso |
SnO3-2 |
Estânico |
|
BrO3-1 |
Brômico |
SnO2-2 |
Estanoso |
|
BrO4-1 |
Perbrômico |
HPO3-2 |
Fosforoso |
|
Cl-1 |
Clorídrico |
MnO4-2 |
Mangânico |
|
ClO-1 |
Hipocloroso |
SiO3-2 |
Metassilícico |
|
ClO2-1 |
Cloroso |
C2O4-2 |
Oxálico |
|
ClO3-1 |
Clórico |
S-2 |
Sulfídrico |
|
ClO4-1 |
Perclórico |
SO4-2 |
Sulfúrico |
|
CN-1 |
Cianídrico |
SO3-2 |
Sulfuroso |
|
F-1 |
Fluorídrico |
S2O3-2 |
Tiossulfúrico |
|
H2PO2-1 |
Hipofosforoso |
ZnO2-2 |
Zíncico |
|
I-1 |
Iodídrico |
PO4-3 |
ortofosfórico |
|
IO-1 |
Hipoiodoso |
SbO4-3 |
Antimônico |
|
IO2-1 |
Iodoso |
SbO3-3 |
Antimonioso |
|
IO3-1 |
Iódico |
AsO4-3 |
Arsênico |
|
IO4-1 |
Periódico |
AsO3-3 |
Arsenioso |
|
MnO4-1 |
Permangânico |
BO3-3 |
Bórico |
|
NO2-1 |
Nitroso |
Fe(CN)6-3 |
Ferricianídrico |
|
NO3-1 |
Nítrico |
PO4-3 |
Ortofosfórico
|
|
OCN-1 |
Ciânico |
Fe(CN)6-4 |
Ferrocianídrico |
|
PO3-1 |
Metafosfórico |
SiO4-4 |
Ortossilícico |
|
SCN-1 |
Tiociânico |
Sb2O7-4 |
Piroantimônico |
|
|
|
As2O7-4 |
Piroarsênico |
|
|
|
P2O7-4 |
Pirofosfórico |
3.
Construa
uma tabela com todos os ácidos, utilizando a tabela de radicais negativos,
conforme o modelo:
|
Radical
negativo |
Fórmula
do ácido |
Nome do ácido |
|
AlO2-1 |
HAlO2 |
Ácido alumínico
|
|
BiO3-1 |
HBiO3 |
Ácido bismútico
|
Presença
de oxigênio na molécula:
o
Hidrácido:
ácido cuja molécula não contém oxigênio. Ex:
HCl, HBr, HCN
o
Oxiácido:
ácido cuja molécula contém oxigênio. Nesse caso, o hidrogênio está ligado
ao átomo de oxigênio, por meio de uma ligação covalente simples. Eles são
classificados como hidrogênios ionizáveis. Ex: HClO, HNO3, H2SO4
Número
de hidrogênios ionizáveis na molécula:
o
Monoácido
ou monoprótico: ácido cuja molécula contém um hidrogênio ionizável, ou
seja, é formado a partir de um radical monovalente (-1). Ex:
HCl, HNO3
o
Diácido
ou diprótico: ácido cuja molécula contém dois hidrogênios ionizáveis, ou
seja, é formado a partir de um radical bivalente (-2).Ex:
H2S, H2SO4
o
Triácido
ou triprótico: ácido cuja molécula contém três hidrogênios ionizáveis, ou
seja, é formado a partir de um radical trivalente (-3).
Ex: H3PO4
o
Tetrácido
ou tetraprótico: ácido cuja molécula contém quatro hidrogênios ionizáveis,
ou seja, é formado a partir de um radical tetravalente (-4).
Ex:H4SiO4
Número
de elementos constituintes:
o
Binário:
ácido cuja molécula contém dois elementos, ou seja, apresenta dois símbolos maiúsculos
(H e outro). Ex: HF
o
Ternário:
ácido cuja molécula contém três elementos, ou seja, apresenta três
símbolos maiúsculos (H e 2 outros). Ex: HNO2
o
Quaternário:
ácido cuja molécula contém quatro elementos, ou seja, apresenta quatro
símbolos maiúsculos (H e 3 outros). Ex: HSCN
Volatilidade:
capacidade
de um ácido em volatilizar (passagem do estado líquido para o estado gasoso).
Analisando os pontos de ebulição dos ácidos, podemos classificá-los em:
o
Fixos:
ácidos que apresentam elevado ponto de ebulição. Ex: H2SO4,
H3PO3, H3PO4, H3BO3.
o
Voláteis:
ácidos que apresentam baixo ponto de ebulição. Ex: HCN, HNO3, HNO2,
H2CO3, H2S, HCl, HBr, HI.
Força:
Para entender a força de um ácido, é necessário entender o fenômeno da
ionização. Todo ácido provém de um composto molecular que, na presença de
água, sofre ionização, liberando unicamente, na forma de íon positivo, o
cátion H+.
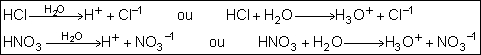
Se
o ácido apresentar mais de um hidrogênio ionizável, a ionização ocorre em
etapas, passando a ser denominada de ionização parcial.
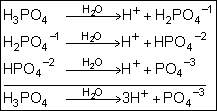
1.
Demonstre
as equações de ionização parcial e total dos seguintes ácidos:
a)
H2SO4
b)
H3BO3
c)
H4P2O7
d)
H2S
e)
H3Fe(CN)6
f)
H4SiO4
O grau de ionização (a) pode ser calculado pela fórmula a seguir e indica a força de um ácido. De modo geral os ácidos são classificados como:
![]()
o
Fracos:
apresentam um grau de ionização inferior a 5%;
o
Moderados:
apresentam um grau de ionização compreendido entre 5% e 50%;
o
Fortes:
apresentam um grau de ionização superior a 50%.
Como
regra prática podemos prever o seguinte:
Hidrácidos:
Fortes: HCl, HBr e HI; Moderado: HF; fracos: Restante;
Oxiácidos:
calcule: número de oxigênio menos número de hidrogênio. Se o resultado for
zero, considere fraco; se o resultado for um, moderado, se dois ou maior que
dois, forte. Lembre-se de que o ácido carbônico (H2CO3)
é uma exceção, sendo fraco (ácido orgânico).
2.
Complete
a tabela:
|
|
CLASSIFICAÇÃO |
|||
|
Nome
do ácido |
Fórmula |
Nº
DE H+ |
Nº
DE ELEMENTOS |
Presença
de oxigênio |
|
Alumínico |
HAlO2 |
monoácido |
ternário |
oxiácido |
|
Antimônico |
|
|
|
|
|
Antimonioso |
|
|
|
|
|
Arsênico |
|
|
|
|
|
Arsenioso |
|
|
|
|
|
Bismútico |
|
|
|
|
|
Bórico |
|
|
|
|
|
Brômico |
|
|
|
|
|
Bromídrico |
|
|
|
|
|
Carbônico |
|
|
|
|
|
Ciânico |
|
|
|
|
|
Cianídrico |
|
|
|
|
|
Clórico |
|
|
|
|
|
Clorídrico |
|
|
|
|
|
Cloroso |
|
|
|
|
|
Crômico |
|
|
|
|
|
Dicrômico |
|
|
|
|
|
Estânico |
|
|
|
|
|
Estanoso |
|
|
|
|
|
Ferricianídrico |
|
|
|
|
|
Ferrocianídrico |
|
|
|
|
|
Fluorídrico |
|
|
|
|
|
Fosforoso |
|
|
|
|
|
hipobromoso |
|
|
|
|
|
Hipocloroso |
|
|
|
|
|
Hipoiodoso |
|
|
|
|
|
Iódico |
|
|
|
|
|
Iodídrico |
|
|
|
|
|
Iodoso |
|
|
|
|
|
Mangânico |
|
|
|
|
|
Metafosfórico |
|
|
|
|
|
Nítrico |
|
|
|
|
|
Nitroso |
|
|
|
|
|
Ortossilícico |
|
|
|
|
|
Oxálico |
|
|
|
|
|
Perbrômico |
|
|
|
|
|
Perclórico |
|
|
|
|
|
Periódico |
|
|
|
|
|
Permangânico |
|
|
|
|
|
Piroantimônico |
|
|
|
|
|
Piroarsênico |
|
|
|
|
|
Pirofosfórico |
|
|
|
|
|
Sulfídrico |
|
|
|
|
|
Sulfúrico |
|
|
|
|
|
Sulfuroso |
|
|
|
|
|
Tiociânico |
|
|
|
|
|
Tiossulfúrico |
|
|
|
|
|
Zíncico |
|
|
|
|
Bases:
É todo composto que, dissolvido em água, gera como ânion o OH-.
Observe as equações de dissociações totais dos hidróxidos de sódio(NaOH) e
de amônio (NH4OH)
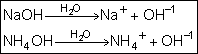
3.
Demonstre as equações de dissociação das seguintes bases:
a)
KOH
b)
AgOH
c)
LiOH
d)
RbOH
Formulação de uma base:
basta acrescentar hidroxila na quantidade da carga positiva do radical,
lembrando sempre que a hidroxila virá sempre depois do radical positivo,
fazendo com que as cargas elétricas se anulem.
|
|
|
|
|
4.
Escreva a fórmula das bases, conforme o exemplo:
|
Ag+1 |
AgOH |
Ni+3 |
Ni(OH)3 |
|
Au+1 |
|
Pb+4 |
|
|
Ba+2 |
|
Pb+2 |
|
|
Be+2
|
|
Mn+4 |
|
|
Ca+2 |
|
Cu+1 |
|
|
Co+2 |
|
Pt+2 |
|
|
Cs+1 |
|
Fe+3
|
|
|
Ni+2 |
|
Co+3 |
|
|
Cu+2
|
|
Au+3 |
|
|
Fe+2 |
|
Sr+2 |
|
|
Hg+1 |
|
Sn+4
|
|
|
Hg+2 |
|
Sn+2 |
|
|
K+1 |
|
Cr+3 |
|
|
Li+1 |
|
Al+3 |
|
|
Mg+2 |
|
Pt+4 |
|
|
Mn+2 |
|
Rb+1 |
|
|
Na+1 |
|
Bi+3 |
|
|
NH4+1 |
|
B+3
|
|
|
|
|
Ra+2 |
|
Classificação de uma base: uma base pode ser classificada de três maneiras:
1-De acordo com o número de hidroxilas:
monobase: apresenta apenas um OH-. Ex: NaOH, KOH, AgOH, NH4OH;
dibase: apresenta duas OH-. Ex: Ca(OH)2, Fe(OH)2, Ba(OH)2;
tribase: apresenta três OH-. Ex: Al(OH)3, Fe(OH)3, Cr(OH)3;
tetrabase: apresenta quatro OH-. Ex: Mn(OH)4, Pt(OH)4;
2-De acordo com a força (grau de dissociação):
Forte: bases formadas por metais alcalinos e alcalino-terrosos;
Fraca: todas as demais;
3-De acordo com a solubilidade em água:
Solúvel: bases alcalinas e hidróxido de amônio (NH4OH);
Pouco solúvel: bases de alcalino-terrosos;
Praticamente insolúvel: as demais
Para
dar nome a uma base, utilize uma tabela de radicais positivos, observando a
condição do elemento:
|
Radicais
positivos |
|
Possuem
uma só valência |
Possuem
duas valências |
|
Monovalentes |
NH4+1,
Li+1, Na+1, K+1, Rb+1, Cs+1,
Ag+1 |
Cu+1,
Hg+1, Au+1 |
|
|
Bivalentes |
Be+2, Mg+2,
Ca+2, Sr+2, Ba+2, Ra+2 |
Cu+2,
Hg+2, Fe+2, Co+2,
Ni+2, Sn+2, Pb+2, Mn+2, Pt+2 |
|
|
Trivalentes |
B+3, Al+3,
Bi+3, Cr+3 |
Au+3,
Fe+3, Co+3, Ni+3 |
|
|
Tetravalentes |
|
Sn+4,
Pb+4, Mn+4, Pt+4 |
![]()
Veja alguns exemplos:
NaOH: hidróxido de sódio;
Ca(OH)2: hidróxido de cálcio;
Al(OH)3: hidróxido de alumínio;
NH4OH: hidróxido de amônio
![]()
Veja alguns exemplos:
AuOH: hidróxido de ouro I;
Fe(OH)2: hidróxido de ferro II;
Au(OH)3: hidróxido de ouro III;
Pt(OH)4: hidróxido de platina IV
![]()
Veja alguns exemplos:
AuOH: hidróxido ouroso;
Au(OH)3: hidróxido áurico;
Fe(OH)2: hidróxido ferroso;
Fe(OH)3: hidróxido férrico.
1.
Construa uma tabela com todos os hidróxidos,
utilizando a tabela de radicais positivos e escrevendo os possíveis
nomes, conforme o modelo:
|
Radical
positivo |
Fórmula
do hidróxido |
Nome do hidróxido |
|
NH4+1 |
NH4OH |
Hidróxido de amônio
|
|
Li+ |
LiOH |
Hidróxido de lítio
|
Número
de hidroxilas na molécula:
o
Monobase:
base que apresenta um OH-1. Ex: NaOH
o
Dibase:
base que apresenta dois OH-1. Ex: Mg(OH)2
o
Tribase:
base que apresenta três OH-1. Ex:
Al(OH)3
o
Tetrabase:
base que apresenta quatro OH-1. Ex: Pt(OH)4
Volatilidade:
capacidade
de uma base em volatilizar (passagem do estado líquido para o estado gasoso).
Analisando os pontos de ebulição das bases, podemos classificá-los em:
o
Fixos:
bases que apresentam elevado ponto de ebulição. Ex: Todas as bases formadas
por metais.
o
Voláteis:
bases que apresentam baixo ponto de ebulição. Ex: NH4OH
Força
ou basicidade:
Para entender a força de uma base, é necessário entender o fenômeno da
dissociação. Toda base provém de um composto que, na presença de água,
sofre dissociação, liberando unicamente, na forma de íon negativo, o OH-1.
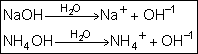
A
dissociação pode ocorre em etapas, passando a ser denominada de dissociação
parcial. Observe:
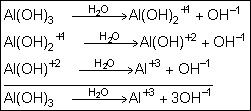
2.
Demonstre
as equações de dissociação parcial e total dos seguintes hidróxidos:
a)
Ca(OH)2
b)
Fe(OH)3
c)
Pt(OH)4
d)
Mg(OH)2
e)
Hg(OH)2
f)
Mn(OH)4
O grau de dissociação (a) pode ser calculado conforme a fórmula abaixo e indica a força de um hidróxido. De modo geral os hidróxidos são classificados como:
![]()
o
Fracos:
apresentam um grau de dissociação próximo de 0%;
o
Fortes:
apresentam um grau de dissociação elevados e próximos de 100%.
Como
regra prática podemos prever o seguinte:
Fortes:
bases formadas por metais alcalinos e alcalino-terrosos.
Fracos:
O
restante das bases.
Solubilidade
em água:
Solubilidade é a propriedade que as substâncias apresentam de se dissolverem
em outras. Assim temos:
o
Solúveis:
bases que se dissolvem em água. Ex: bases de metais alcalinos e o NH4OH;
o
Pouco
solúveis:
Ex: bases de metais alcalino-terrosos;
o
Insolúveis:
bases que não se dissolvem em água. Ex: Restante
3.
Complete
a tabela:
|
|
CLASSIFICAÇÃO |
|||
|
Radical
positivo |
Fórmula |
Nº
DE OH-1 |
Solubilidade
em água |
Força |
|
Ag+1 |
AgOH |
monobase |
Insolúvel
|
fraco |
|
Al+3 |
|
|
|
|
|
Au+1 |
|
|
|
|
|
Au+3 |
|
|
|
|
|
B+3
|
|
|
|
|
|
Ba+2 |
|
|
|
|
|
Be+2
|
|
|
|
|
|
Bi+3 |
|
|
|
|
|
Ca+2 |
|
|
|
|
|
Co+2 |
|
|
|
|
|
Co+3 |
|
|
|
|
|
Cr+3 |
|
|
|
|
|
Cs+1 |
|
|
|
|
|
Cu+1 |
|
|
|
|
|
Cu+2
|
|
|
|
|
|
Fe+2 |
|
|
|
|
|
Fe+3
|
|
|
|
|
|
Hg+1 |
|
|
|
|
|
Hg+2 |
|
|
|
|
|
K+1 |
|
|
|
|
|
Li+1 |
|
|
|
|
|
Mg+2 |
|
|
|
|
|
Mn+2 |
|
|
|
|
|
Mn+4 |
|
|
|
|
|
Na+1 |
|
|
|
|
|
NH4+1
|
|
|
|
|
|
Ni+2 |
|
|
|
|
|
Ni+3 |
|
|
|
|
|
Pb+2 |
|
|
|
|
|
Pb+4 |
|
|
|
|
|
Pt+2 |
|
|
|
|
|
Pt+4 |
|
|
|
|
|
Ra+2 |
|
|
|
|
|
Rb+1 |
|
|
|
|
|
Sn+2 |
|
|
|
|
|
Sn+4
|
|
|
|
|
|
Sr+2 |
|
|
|
|