

Densidade absoluta: é o quociente entre a massa e o volume do gás nas condições consideradas de pressão e temperatura. Também pode ser denominada de massa específica.
![]()
Com respeito à densidade absoluta devemos notar que:
Em geral, ela é expressa em gramas por litro (g/L);
Ela depende da pressão e da temperatura em que o gás se encontra; isso porque a massa não depende da temperatura e pressão, mas o volume depende;
No lugar da massa podemos usar a massa molar (M) do gás, desde que no lugar do volume seja usado o volume molar; disto resulta a equação particular:
![]()
Podemos calcular a densidade absoluta em qualquer pressão e temperatura, com o auxílio da equação de Clapeyron:
![]()
Observe que a densidade do gás diminui com o aumento da temperatura. Dentre as aplicações mais antigas desse fato, destacamos os balões das festas juninas e os balões de ar quente usados em competições esportivas.
Densidade relativa: é o quociente entre as densidades absolutas dos gases 1 e 2 ambas sendo medidas nas mesmas condições de pressão e temperatura.
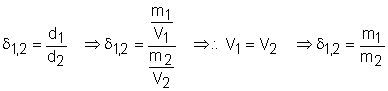
Considerando a massa molar e o volume molar dos gases:
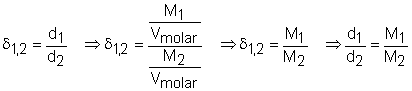
Essas fórmulas são importantes porque mostram que as densidades dos gases são proporcionais às suas massas molares. Desse modo, quando verificamos que um gás é, por exemplo, quatro vezes mais denso que outro, já podemos concluir que cada molécula do primeiro gás pesa quatro vezes mais do que cada molécula do segundo. Isso facilita a determinação das massas moleculares no laboratório.
É importante ressaltar que o ar atmosférico apresenta massa molar média igual a 28,9.
Difusão e efusão dos gases
Efusão: é a passagem de um gás através de pequenos orifícios. A passagem de um gás através de uma parede porosa é uma efusão, pois a parede porosa é um conjunto de pequenos orifícios.
Difusão: é a propriedade de duas ou mais substâncias se misturarem espontaneamente, quando colocadas em presença uma das outras, daí resultando soluções (misturas homogêneas).
Em 1828, baseado em dados experimentais, o físico inglês Graham estabeleceu uma relação matemática, denominada LEI DE GRAHAM: a velocidade de difusão e efusão de um gás é inversamente proporcional à raiz quadrada de sua densidade. Numa mesma pressão e temperatura, a relação entre as densidades dos dois gases é igual à relação entre suas massas molares, portanto:

Fração molar de gases
É o quociente entre o número de mols de A em relação à quantidade de mols da mistura. Dessa forma, podemos afirmar que a relação entre o número de mols de um gás e o número total de mols da mistura é conhecida como fração molar ou fração em quantidade de matéria. Veja:
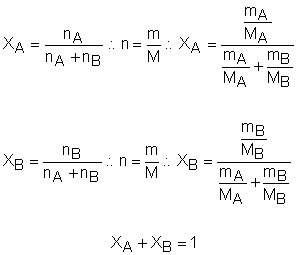
Mistura de gases
Muitos sistemas gasosos são mistura de gases, como, por exemplo, o ar que respiramos. Toda mistura de gases é sempre um sistema homogêneo.
Pressão parcial (Lei de Dalton): Numa mistura gasosa, pressão parcial de um gás é a pressão que ele iria exercer se estivesse sozinho, ocupando o volume total da mistura e na mesma temperatura em que a mistura se encontra. A pressão total de uma mistura gasosa é a soma das pressões parciais de todos os gases componentes da mistura.
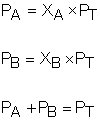
Volume parcial: Numa mistura gasosa, volume parcial de um gás é o volume que ele iria ocupar se estivesse sozinho, sendo submetido à pressão total da mistura e na mesma temperatura em que a mistura se encontra. O volume total de uma mistura gasosa é a soma dos volumes parciais de todos os gases componentes da mistura.
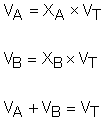
Exercícios
1.
(Fuvest-SP) Nas condições normais de temperatura e pressão, qual o
volume ocupado por 10g de monóxido de carbono (CO)?
2.
(ITA-SP) A pressão total do ar no interior de um pneu era de 2,30 atm
quando a temperatura do pneu era de 27O C. Depois de ter rodado certo
tempo com esse pneu, mediu-se novamente sua pressão e verificou-se que ela era
agora de 2,53 atm. Supondo uma variação do volume do pneu desprezível, qual a
nova temperatura (em O C)?
3.
(PUC-SP) Qual a massa, em gramas, de gás carbônico contido em um
recipiente de volume igual a 11,2 L nas CNTP?
4.
(UFBA) 30g de uma substância pura, no estado gasoso, ocupam um volume de
12,3 L à temperatura de 327OC e à pressão de 3 atm. Calcule a
massa molecular dessa substância.
5.
(UFPE) Uma certa quantidade de gás ideal ocupa 30 L à pressão de 2 atm
e à temperatura de 300 K. Que volume, em litros, passará a ocupar se a
temperatura e a pressão tiverem seus valores dobrados?
6.
(UFRS) Um extintor de incêndio contém 4,4 kg de gás carbônico. Qual o
volume máximo (em litros) de gás que é liberado na atmosfera, a 27O
C e 1 atm?
7.
(UFSC) Suponha que 57 L de um gás ideal a 27O C e 1,00 atm
sejam simultaneamente aquecidos e comprimidos até que a temperatura seja 127O
C e a pressão, 2,00 atm. Qual o volume final, em L?
8.
(UFU-MG) Nas CNTP, isolam-se as seguintes amostras gasosas: 10 L de xenônio
(Xe) , 20 L de cloro (Cl2), 30 L de butano (C4H10),
40 L de gás carbônico e 50 L de neônio (Ne). Qual a amostra com maior massa,
expressa em gramas?
9.
(Unaerp-SP) O argônio é um gás raro utilizado em solda, por arco
voltaico, de peças de aço inoxidável. Qual a
massa de argônio contida num cilindro de 9,84 L que, a 27O C,
exerce uma pressão de 5 atm?
10.
(Unicamp-SP) Uma garrafa de 1,5 L, indeformável e seca, foi fechada por
uma tampa plástica. A pressão ambiente era de 1,0 atm e a temperatura, de 27O
C. Em seguida, essa garrafa foi colocada ao sol e, após certo tempo, a
temperatura em seu interior subiu para 57O C e a tampa foi
arremessada pelo efeito da pressão interna. Qual era a pressão no interior da
garrafa no instante imediatamente anterior à expulsão da tampa plástica?
11.
(UNI-RIO) 29,0g de uma substância pura e orgânica, no estado gasoso,
ocupam um volume de 8,20 L à temperatura de 127O C e à pressão de
1520 mmHg. Qual a massa molecular do provável gás?
12.
100 L de um gás submetido a 27O C são aquecidos a 87O C
e a pressão é mantida constante. Qual o volume ocupado pelo gás a 87O C?
13.
100 mL de gás metano, a 37O C, são aquecidos a 57O
C, à pressão constante. Calcule o novo volume, em L.
14.
A 27OC determinada massa de gás carbônico (CO2)
ocupa o volume de 5000 cm3 e
exerce a pressão de 580 mmHg. Calcule a massa desse gás.
15.
A densidade absoluta de um gás X nas CNTP é igual a 1,5 g/L. Determine
a massa molecular desse gás.
16.
A densidade de um gás A em relação ao ar é igual a 1,5. Ache o volume
ocupado por 173,4g desse gás nas CNTP.
17.
A densidade de um gás B, em relação ao nitrogênio, é igual a 4,5.
Qual é a massa molecular de B?
18.
A densidade de um gás G, em relação ao metano é igual a 3. Determine
a massa molecular de G.
19.
A massa de 5,5g de um gás, quando recolhido nas CNTP, ocupa 2,8 L. Qual
a massa molecular do referido gás?
20.
À temperatura constante, o volume ocupado por um gás depende da pressão
a que é submetido. Assim, uma amostra de O2 ocupa um volume de
441,62 mL quando sob pressão de 740,00 mmHg. Que volume ocupará a massa
gasosa, quando sob pressão de 1,0 atm?
21.
Calcular a densidade do gás carbônico em relação ao gás metano (CH4).
22.
Calcule a densidade absoluta do CH4
nas CNTP e a 27O C e 600mmHg.
23.
Calcule a densidade absoluta do Cl2
nas CNTP e a 18OC e 873mmHg.
24.
Calcule a densidade absoluta do CO2
nas CNTP e a 47O C e 1,6 atm
25.
Calcule a densidade absoluta do H2
nas CNTP e a 17OC e 0,58 atm.
26.
Calcule a densidade absoluta do N2
nas CNTP e a 7OC e 2,8 atm.
27.
Calcule a densidade absoluta do O2
nas CNTP e a 27OC e 3 atm.
28.
Calcule a massa de gás metano (CH4) necessária para, a 27°C
e ocupando o volume de 24600 cm3, exercer a pressão de 190 mmHg.
29.
Calcule a massa molecular de um gás A, cuja densidade em relação ao ar
é 0,8.
30.
Calcule a massa molecular de um gás A, sabendo que a -23O C e
5 atm a sua densidade absoluta é de 10,5 g/L.
31.
Calcule a pressão exercida por 6,4 g de gás metano (CH4), á
temperatura de 47O C contidos num frasco com capacidade de
8 L.
32.
Calcule a qual pressão, em atm, 4,40g de dióxido de carbono ocupam um
volume de 44,8 L a 273O C.
33.
Calcule o volume, em litros, que deve ocupar 0,068 kg de gás amoníaco
(NH3) para que, à
temperatura de 32O C, esse gás exerça a pressão de 1830mmHg.
34.
Certa massa de hélio está contida num recipiente com capacidade de 8 L,
à temperatura de 127OC, exercendo a pressão de 2 atm. Se o volume
dessa massa de gás se reduzir a 3/4 do inicial,
a que temperatura ela deverá ser submetida para que sua pressão se
reduza também a 3/4 da inicial?
35.
Certa massa de metano encontra-se num recipiente com capacidade de 8 L,
à temperatura de 47O C, exercendo
a pressão de 5 atm. Calcule a pressão, em cmHg,
exercida por essa massa de metano se o volume se reduzir à metade e a
temperatura aumentar para 127OC.
36.
Certa massa gasosa se encontra num frasco fechado, a 27 ° C. A que
temperatura essa massa deverá ser submetida para que sua pressão se reduza a
4/5 da inicial, sem variar o volume.
37.
Certa massa gasosa, mantida em um frasco fechado, tem pressão igual a
190 mmHg a 27O C. a qual temperatura (em O C) a pressão
esse gás no frasco fechado será igual a 0,5 atm?
38.
Considerando as CNTP, calcule a massa de gás hélio correspondente a 56
L.
39.
Considerando as CNTP, calcule o volume ocupado pelas seguintes
quantidades de gás: 0,15 mol; 0,20 mol; 0,05 mol e 25,0 mols
40.
Considerando um recipiente contendo 64g de
gás oxigênio e 112g de gás nitrogênio, determinar as frações
molares dos dois gases.
41.
Considere 50 g de um gás A, contidos num recipiente com capacidade de
31,15 L, à temperatura de 17O C e à pressão de 1160 mmHg. Descubra
a densidade desse gás em relação ao ar.
42.
Considere a mistura gasosa contendo 12g de H2 e 32g de CH4,
a 2 atm. Calcule, para cada um dos componentes a fração molar e a pressão
parcial.
43.
Considere um gás X, num recipiente com capacidade de 100 L, mantido a 27O
C e pressão de 4 atm, e um gás Y, num recipiente com capacidade de 200l,
a 254OC e 10 atm. Esses dois gases são misturados num recipiente de
160 L, mantido a 94O C. Calcular a pressão da mistura;
os volumes e as pressões parciais dos componentes;
44.
Descubra a densidade do neônio (Ne) em relação ao ar.
45.
Descubra a massa molecular de um gás A, cuja densidade em relação ao gás
hidrogênio é 27.
46.
Descubra as frações molares dos componentes da seguinte mistura: 264 g
de gás carbônico (CO2) e 256g de dióxido de enxofre (SO2).
47.
Descubra os volumes parciais dos gases componentes da seguinte mistura
contida num frasco com capacidade de 3 L: 16 g de dióxido de enxofre (SO2),
16 g de metano (CH4) e 21 g de gás nitrogênio (N2) .
48.
Descubra quantas vezes o gás nitrogênio é mais denso que o hélio
(He).
49.
Determinar a massa molecular de um gás, sabendo que a sua densidade em
relação ao ar é 1,5.
50.
Determinar a pressão exercida por 9,6g de gás oxigênio, contidos em um
recipiente com capacidade de 8,2 L a 27O C.
51.
Determine a densidade do etano (C2H6) em relação
ao gás hidrogênio.
52.
Determine a densidade absoluta do gás amoníaco (NH3) e a 47O
C e 1,6 atm.
53. Determine a densidade do oxigênio (O2) em relação ao metano (CH4).
54. Determine a densidade do oxigênio (O2) em relação ao acetileno (C2H2).
55.
Determine a pressão exercida por 4 g de hidrogênio (H2),
sabendo que a 27°C o volume ocupado por esse gás é de 98,4 L.
56.
Determine o volume ocupado por 30 g de um gás X nas CNTP, sabendo que a
sua densidade em relação ao hidrogênio é igual a 10.
57.
Determine, em gramas, a massa de gás hidrogênio
necessária para exercer a pressão de 900 mmHg a 27° C, num recipiente
com capacidade de 24,92 L.
58.
Em um dia de inverno, à temperatura de 0O C, foi colocada uma
amostra de ar, à pressão de 1,0 atm, em um recipiente de volume constante.
Transportando essa amostra para um ambiente de 60O C, que pressão
ela apresentará?
59.
Num balão com capacidade de 5 L são misturados: 2 L de um gás A, a 500
mmHg; 0,5 L de um gás B, a 1140
mmHg; e 2,5 L de um gás C, a 800 mmHg. Calcule a pressão exercida por essa
mistura, sabendo que a temperatura é mantida constante.
60.
Num balão de 200 L de capacidade, mantido à temperatura constante de
300K, são colocados 110 L de N2 a 5 atm e 57,0OC, 80 L de
O2 a 2,5 atm e -23OC e 50 L de Ne a 3,2 atm e 47OC.
Qual a pressão total da mistura, em mmHg?
61.
Num recipiente com capacidade de 5l
está contido um gás à temperatura de O° C e à pressão de 1 atm. Determine
a pressão, em mmHg, exercida pela massa desse gás quando ele estiver num
recipiente com capacidade de 8 L e à temperatura de 0O C.
62.
Num tanque de gás, havia 8,2 m3 de oxigênio a –23O
C e 2 atm de pressão. Tendo ocorrido um vazamento, verificou-se que a pressão
diminuiu em 0,5 atm. Que massa de oxigênio foi perdida, sabendo que a
temperatura permaneceu constante?
63.
Os sucos de frutas engarrafados encontrados nas prateleiras dos
supermercados contém conservantes químicos, e um desses é o dióxido de
enxofre (SO2), substância gasosa nas condições ambientes.
Recentemente, os jornais, rádios e as TVs anunciaram a retirada de muitos
desses sucos do mercado, pelo fato de conterem um teor de conservante maior que
o permitido oficialmente. Qual a quantidade (em mol) de dióxido de enxofre
contido num recipiente de volume igual a 1,0 L sob pressão de 22,4 atm, mantido
a 273K?
64.
Para que uma amostra gasosa que ocupa um volume de 6,0 L e se encontra a
1 atm tenha sua pressão modificada para 1140 mmHg, mantendo-se constante a
temperatura, qual deverá ser o novo volume?
65.
Qual a massa molecular de 135g de uma substância gasosa que está dentro
de um recipiente de 3 litros a uma pressão de 5 atm e a uma temperatura de 27O
C?
66.
Qual a pressão exercida por 10 g de hidrogênio (H2), a 27O
C, contidos num recipiente com capacidade de 8200 cm3 ?
67.
Qual o volume de um balão contendo 44,0g de gás hélio, utilizado em
parques de diversões ou em propaganda, num dia em que a temperatura é 32O
C e a pressão do balão é 2,5 atm?
68.
Qual o volume ocupado nas CNTP por 3,01x1022 moléculas de um
gás?
69.
Quantos mols de gás nitrogênio existem em um cilindro que contém 6,72
L desse gás, nas CNTP?
70.
Um cilindro provido de êmbolo móvel e de massa desprezível contém no
seu interior 2,0g de hélio. Determine a pressão que deverá ser aplicada ao êmbolo
para mantê-lo em equilíbrio estático, de modo que o gás ocupe um volume de
10 L, sabendo que a temperatura do conjunto é de 127OC.
71.
Um dos equipamentos mais comuns de camping é o botijão de gás
propano (C3H8), de volume igual a 5,0 L e conteúdo de 3,0
kg de propano líquido. Qual deve ser o volume de um recipiente que contenha a
mesma quantidade do propano gasoso a 25O C e a 1 atm?
72.
Um dos poluentes mais comuns é o monóxido de carbono. Uma amostra
contendo 4 mols desse gás exerce uma pressão de 2,46 atm a 27O C.
Nessas condições, determine o volume ocupado pelo gás.
73.
Um frasco com capacidade de 10 L contém 70 g de gás nitrogênio (N2),
a 7OC. Determine a pressão exercida por esse gás.
74.
Um frasco fechado, com capacidade de 16,4 L, contém gás metano (CH4),
a 27OC, exercendo a pressão de 2,1 atm. Calcule a massa, em gramas,
desse gás.
75.
Um frasco fechado, com capacidade de 8,0 L, contém 6 g de gás etano (C2H6),
exercendo a pressão de 623 mmHg. Descubra a temperatura, em OC,
em que esse gás se encontra.
76.
Um gás A é mantido num recipiente com capacidade de 2 L, a 27°C e 3
atm, e um gás B encontra-se num recipiente de 3 L, a 47OC e 1,6 atm.
Se misturarmos esses gases e colocarmos a mistura num recipiente de 1,4 L, à
temperatura de 7OC, quais serão as pressões e os volumes parciais
dos gases A e B?
77.
Um gás A encontra-se num recipiente com capacidade de 220 L, a 157OC
e 15 atm, e um gás B num recipiente com capacidade de 180 L, a -223°C e 2,5
atm. Esses gases são misturados num outro recipiente, com capacidade de 500 L,
mantido a 127°C. Determine a pressão da mistura e as pressões e os volumes
parciais dos gases A e B.
78.
Um gás X encontra-se num recipiente de 30 L, a 27OC e 1 atm,
e um gás Y num recipiente de 250 L, a -23O
C e 1,5 atm. Esses dois gases são misturados num recipiente com capacidade de
200 L, e a mistura é mantida a uma temperatura tal que sua pressão é de 2 atm.
Calcule a temperatura, em OC da
mistura e as pressões e os volumes parciais dos componentes X e Y.
79.
Um menino deixou escapar um balão contendo 2 L de gás hélio, a 20O
C e pressão de 2 atm. Quando atingir uma altura em que sua pressão seja 0,5
atm e sua temperatura 10O C, qual será o volume ocupado pelo gás após
a subida?
80.
Um recipiente A, com capacidade de 4,1 L, contém gás oxigênio a 17°C,
exercendo a pressão de 2,32 atm. Outro recipiente B, com capacidade de 6,15 L,
contém gás metano (CH4), exercendo a pressão de 3,28 atm, a 27OC.
Qual dos dois recipientes contém a maior massa de gás? Justifique.
81.
Um recipiente com capacidade de 5 L contém 20,4 g de sulfidreto (H2S)
e 13,2 g de propano (C3H8). Calcule os volumes parciais
desses gases.
82.
Um recipiente com capacidade de 50 L contém certa massa de um gás a 0O
C, exercendo a pressão de 1 atm. Calcule a pressão, em cmHg, que a massa desse
gás exercerá quando encerrada num recipiente com capacidade de 80 L, à
temperatura de 273° C.
83.
Um recipiente com capacidade de 8, 2 L contém 0, 8 mol de moléculas de
um gás. Calcule a temperatura, em OC, a que se deve submeter esse gás
para que ele exerça a pressão de 2,5 atm.
84.
Um recipiente com capacidade de 8,2 L contém 160g de um gás X a 34OC
e 2,90 atm. Calcule a densidade desse gás em relação ao gás hidrogênio (H2).
85.
Um recipiente com capacidade de 41 L contém 2,408x1023 moléculas
de um gás. Calcule a temperatura, em OC, a que se deve submeter esse
gás para que ele exerça a pressão de 1,25 atm.
86.
Um recipiente com capacidade de 80 L contém oxigênio a 20O
C, exercendo a pressão de 5 atm. Outro recipiente, com capacidade de 50 L,
contém hidrogênio a 20O C, exercendo a pressão de 2 atm.
Que pressão exercerá a mistura desses dois gases num recipiente com capacidade
para 25 L, a 20O C?
87.
Um recipiente contém 12,8 g de gás metano (CH4) e 36 g de
etano (C2H6 ). Admitindo que a pressão exercida por essa
mistura seja de 3atm, calcule as pressões parciais desses gases.
88.
Um recipiente contém 8 g de gás oxigênio e 40 g de trióxido de
enxofre (SO3). Determine as frações molares dos gases componentes
dessa mistura.
89.
Um recipiente de capacidade igual a 5,8 L e mantido a 27OC
contém 12,8g de O2, 8g de He e 14g de N2. Calcule a pressão
total do sistema e a pressão parcial do gás que tem a maior fração molar na
mistura.
90.
Um recipiente fechado contém 22 g de gás carbônico (CO2 ),
a 17OC. Ache o volume, em litros, ocupado por esse gás, sabendo que
ele exerce a pressão de 1,45 atm.
91.
Um recipiente fechado contém 5 moles de moléculas de nitrogênio (N2),
a 27OC, exercendo a pressão de 600 mmHg. Calcule a capacidade desse
recipiente.
92.
Uma amostra de nitrogênio gasoso ocupa 20 mL, a 27O C e à
pressão de 800 mmHg. Que volume ocuparia a amostra a 0O C e 800 mmHg?
93.
Uma mistura gasosa é constituída por 24 g de hélio, 38 g de gás amoníaco
(NH3 ) e 106 g de gás nitrogênio. Calcule as frações molares dos
componentes dessa mistura.
94.
Uma mistura gasosa é formada por 14,2g de gás cloro (Cl2)
e 13,2g de gás carbônico (CO2). Calcular as pressões parciais
desses componentes, supondo que a pressão da mistura seja de 10 atm.
95.
Uma mistura gasosa exerce a pressão de 1,8 atm. Sabendo que a mistura é
formada por 11g de gás carbônico (CO2) e 39 g de acetileno (C2H2),
determine as pressões parciais desses componentes.